李珊珊/余希岚团队发现代谢调控自噬的新机制
作者:九游会老哥俱乐部发布时间:2023年03月09日 10:22
近日,九游会老哥俱乐部、省部共建生物催化与酶工程国家重点实验室李珊珊/余希岚团队在Science子刊(Science Advances)上以长文形式发表了题为“The TORC1 activates Rpd3L complex to deacetylate Ino80 and H2A.Z and repress autophagy”的研究论文(图1)。该研究揭示了外界营养变化调节自噬的新机制。湖北大学博士生李鑫为本文第一作者,李珊珊教授与余希岚教授为本文通讯作者,湖北大学为第一单位。

图1 文章首页
当细胞面临饥饿情况时,细胞会自发地通过溶酶体“吃掉”自身损坏的蛋白或细胞器,以维持细胞的生存。这个过程称为自噬。自噬可防止细胞损伤,对于维持细胞、组织以及器官的稳态至关重要。自噬功能的缺失或者紊乱会诱发一系列疾病包括神经退行性疾病、炎症甚至癌症。2016年诺贝尔生理或医学奖授予日本科学家大隅良典,以表彰他对细胞的自噬机制的发现和相关研究。在营养充足条件时,自噬被维持在基础水平;然而,在饥饿条件下,自噬被迅速诱导为较高的水平。然而,营养饥饿诱导自噬发生的机制尚未完全清楚。
近来研究表明自噬受到表观遗传修饰的调控。其中,组蛋白去乙酰化酶Rpd3L复合物被报道可以通过抑制自噬基因的转录,使自噬活性维持在基础水平。然而,组蛋白乙酰化也被报道抑制自噬。这是长期以来困扰本领域的一个难题。2022年,李珊珊教授与余希岚教授合作在Nature子刊(Nature Structural & Molecular Biology)上报道了Rpd3可通过催化SAGA复合物来抑制代谢压力应激相关基因的表达,从而使细胞适应外界营养变化,提示Rpd3L复合物可能通过催化非组蛋白的去乙酰化来抑制自噬活性。
在本研究中,李珊珊/余希岚团队通过蛋白质纯化结合质谱技术发现染色质重塑复合物INO80为Rpd3L复合物的新靶点。Rpd3L复合物通过去乙酰化Ino80 上的K929位点,阻止Ino80被自噬降解,从而稳定Ino80蛋白水平。Ino80使组蛋白变体H2A.Z从自噬基因上解离,从而抑制自噬基因转录。进一步研究发现Rpd3L复合物活性受到营养感知器TORC1的调控。当细胞在富含营养的条件下生长时,TORC1被激活,Rpd3L复合物去乙酰化Ino80 K929、稳定Ino80,抑制自噬基因转录。当细胞在营养缺乏条件下,TORC1失活导致Rpd3L复合物解体,Rpd3L去乙酰化酶活性降低,Ino80被高度乙酰化,从而被自噬降解。H2A.Z随之富集在自噬相关基因的启动子处,增强自噬基因的转录,最终促进自噬(图2)。
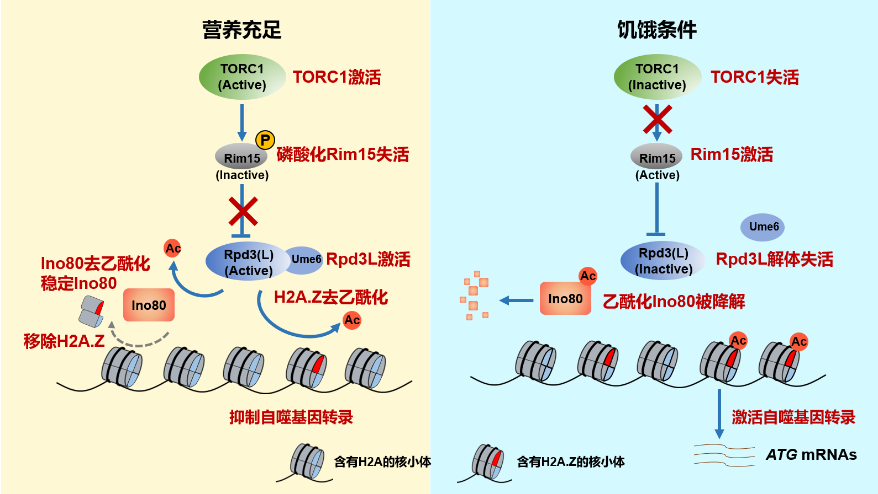
图2 TORC1激活Rpd3L复合物去乙酰化Ino80并抑制自噬
该研究证明了Rpd3L抑制自噬相关基因的转录,是通过去乙酰化染色质重塑复合物Ino80而不是核心组蛋白,解释了领域中组蛋白去乙酰化酶和组蛋白乙酰化均可抑制自噬这个看似矛盾的现象,并创新性地将营养物质的感知、染色质重塑和基因转录有机地联系起来,揭示了代谢调控自噬的表观遗传机制。
据悉,李珊珊教授和余希岚教授团队一直从事糖代谢调控衰老与肿瘤发生的表观遗传学研究。自2015年底加盟九游会老哥俱乐部以来,近5年以湖北大学为第一单位在Nature Metabolism、Nature Structural & Molecular Biology、Science Advances、Nature Communications (3篇)、Nucleic Acids Research (2篇)、Oncogene等国际知名权威期刊上发表20余篇高水平文章,并获得国家自然科学基金面上项目、青年项目、湖北省创新群体、湖北省杰青项目等多项国家级和省部级科研项目的支持。
原文链接:http://www.science.org/doi/10.1126/sciadv.ade8312



