近日,省部共建生物催化与酶工程国家重点实验室陈纯琪教授研究团队和马立新教授、郭瑞庭教授共同合作,首次报道了自给自足P450酶的全长三维结构,相关研究以“Structural insight into the electron transfer pathway of a self-sufficient P450 monooxygenase”(«自给自足P450酶的全长结构与电子传递途径»)为题发表在Nature Communications(图1)。

图1文章首页
细胞色素P450酶是一类广泛存在于各种生物体的金属酶,参与许多天然产物的合成途径与毒物和药物代谢反应。绝大多数P450酶需要氧化还原酶来提供电子以活化底物结合区的血红素,进而转化底物,而自给自足P450酶在同一条多肽链上自带氧化还原酶,因而在生物技术应用方面是极具吸引力的生物催化剂。迄今数十年以来,面对自给自足P450酶结构获取困难、电子传递方式和通路不明晰等问题,其机理一直未得到很好的研究。
针对上述问题,为了研究自给自足P450酶电子传递的机理,陈纯琪教授研究团队解析了来源于Tepidiphilus thermophilus的CYP116B46的晶体结构,建立了清晰的蛋白质模型(图2),并阐明其电子传递途径从FMN通过[2Fe-2S]到heme。该工作首次报道了几十年来第一个自给自足P450酶的全长三维结构,此工作对了解自给自足P450酶催化机理是一个非常重要的里程碑,并对P450酶的改造和应用具有重要的指导意义。
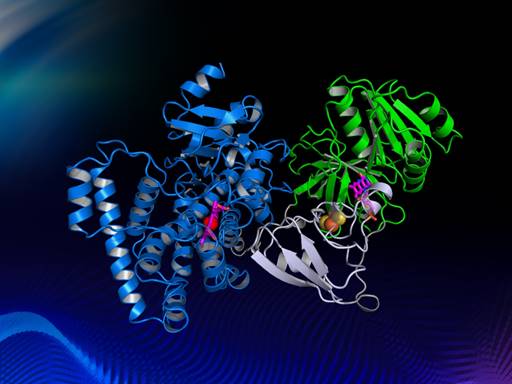
图2 自给自足P450酶Tepidiphilus thermophilus的晶体结构模型
陈纯琪教授研究团队一直从事工业酶分子结构的研究,团队中博后张丽兰、“十年树人”硕士研究生谢珍珍和本科生刘紫薇为本文的共同第一作者。自加盟省部共建生物催化与酶工程国家重点实验室以来,陈纯琪教授研究团队在Nature Reviews Chemistry (IF:30.628)、ACS Catalysis (IF: 12.22)、Angew. Chem. Int. Ed. (IF: 12.257) 和Nature Communications (IF: 11.878)等国际权威期刊上发表多篇高水平文章,并获得国家重点研发计划课题、国家自然科学基金面上项目等项目支持。
文章链接:https://www.nature.com/articles/s41467-020-16500-5




